今回は珍しい薬について解説していきたいと思います。
ゾルゲンスマとは?
ゾルゲンスマは脊髄性筋萎縮症という疾患の治療薬です。成分名を「オナセムノゲンアベパルボベグ」といい、アデノ随伴ウイルスベクター(AAV9)にSMN遺伝子を組み込んだ遺伝子治療薬です。一回使用すると体内にAAV9に対する抗体が形成されるため、繰り返し使用することは出来ません。
ゾルゲンスマは人工呼吸器なしでは2年以上生存することが出来ないと言われている「乳児型脊髄性筋萎縮症」を1回で治療することが出来る薬として登場しました。
発売当初の価格は212万5000ドルで、日本円では現在のレートである1ドル130円で換算すると、2億7625万円となります。さすがに、登場時の価格なので現在はもう少し控えめになっていますが、とんでもない値段がついています。
日本でも保険適応になっており、2020年3月に承認が下りました。その価格はなんと1億6707万7222円で、日本で初めての億を超える新薬が誕生しました。その前の最高額がキムリアという白血病の薬で、3349万3407円でした。なんと5倍くらい違います。
薬価がどうやって決まったのか?
既に脊髄性筋萎縮症には2019年7月にスピンラザが承認されていたため、ゾルゲンスマの薬価は「類似薬効比較方式」で決定されました。類似薬効比較方式とは、対象疾患や作用機序、投与経路などが最も似ている最類似薬を基準に薬価を決める方法です。平たく言えば、似たような薬は大体同じような値段にする感じです。
しかし、ゾルゲンスマの薬価が決定される時点でスピンラザは949万3024円でした。
似た薬は似た値段にという話と全然違うじゃないかと思われるでしょう。
というわけで、何故ここまで価格に違いがあるのかを解説します

ゾルゲンスマがここまで高価に設定された理由は、それぞれの薬の特徴にあります。
スピンラザは1回で完結するわけではなく、継続した投与が必要な薬です。安定している場合は4か月おきに投与が必要になります。
それに対してゾルゲンスマは1回の投与で「長期的な有効性がある」ということが確認できています。スピンラザのように4か月に1回の投与が必要ではないのです。
したがって、ゾルゲンスマを使用することで不要になったスピンラザが何回分か?ということが薬価に組み込まれたわけです。ゾルゲンスマは、スピンラザ11回分と計算されたため、それで約1億円です。残りは特定の条件を満たすと薬価に加算が入るので、それで60%価格が上乗せされた結果この値段が設定されたというわけです。
脊髄性筋萎縮症
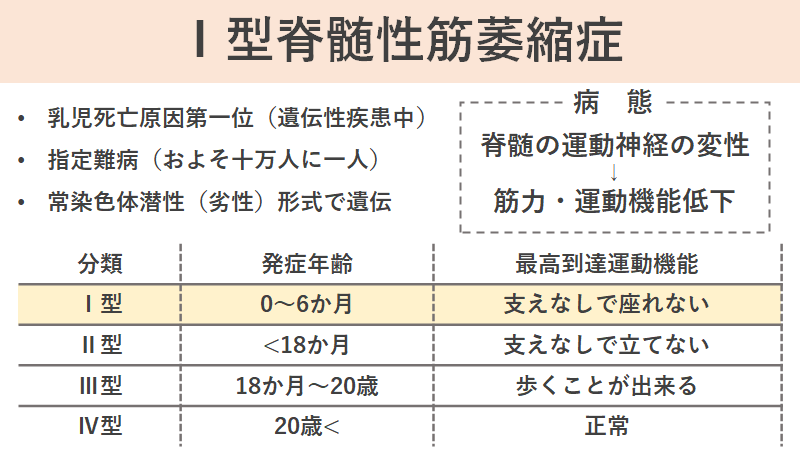
脊髄性筋萎縮症は、遺伝性疾患のうち乳児の死亡原因の第一位で、指定難病の一つです。およそ十万人に一人の非常に稀な疾患とされています。
簡単に病態について説明します。
体を動かす時には筋肉が動くことが必須ですが、脊髄性筋萎縮症では脊髄の運動神経が変性してしまうため、筋肉の力が弱まり、運動機能が低下してしまいます。
今回はゾルゲンスマの話ということで、Ⅰ型からⅣ型までが存在していますが、Ⅰ型に注目してみていきます。
Ⅰ型脊髄性筋萎縮症は別名をウェルドニッヒ・ホフマン病といいます。特に小児期に発症するもので、重症型として知られています。
生後6か月ごろまでに発症し、運動発達が停止するため、体幹を動かすことも出来なくなってしまうようです。死亡年齢は平均6~9か月で、95%は18か月までに死亡すると言われています。未治療のままだと、支えなしで座ることが出来ないレベルの運動機能が限界と言われています。
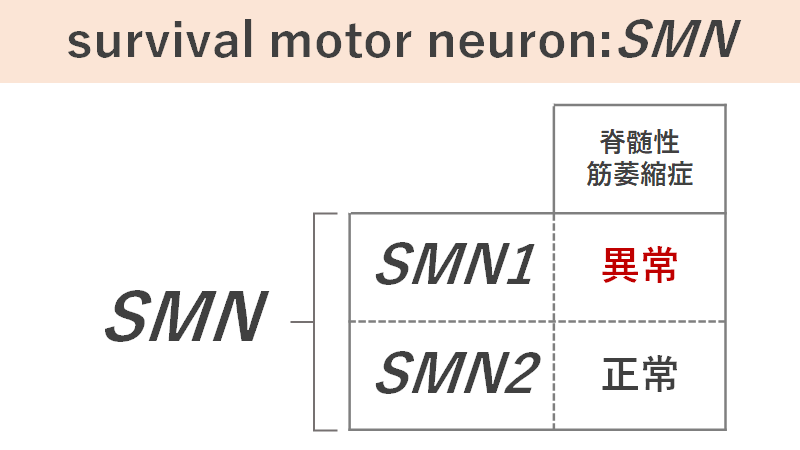
この疾患の原因となる遺伝子は、「survival motor neuron:SMN遺伝子」です。SMN遺伝子にはSMN1とSMN2の2種類が存在していますが、SMN1の欠失または変異が主な原因となります。遺伝子の異常が原因のため、この疾患は常染色体潜性遺伝(劣性遺伝)形式で遺伝することが分かっています。
SMN遺伝子の機能
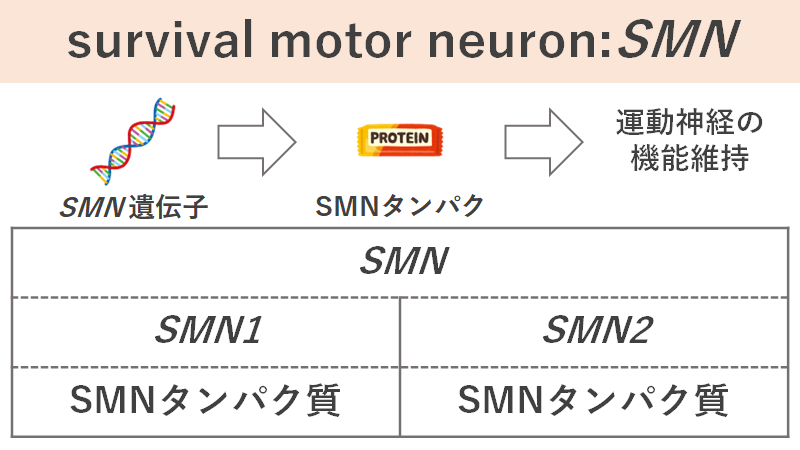
それぞれのSMN遺伝子はSMNというタンパク質を発現しています。SMNタンパク質の機能についてははっきりわかっているわけではありませんが、様々な組織や細胞で発現しているということが知られています。SMN1,2両方の遺伝子でSMNタンパク質の発現が見られますが、SMN1からの発現が大部分を占めるようです。
そして、脊髄中の運動神経の機能を維持するために「正常なSMNタンパク質」が必要であることが明らかになっています。

脊髄性筋萎縮症ではSMN1遺伝子の機能異常が発生しているため、正常なSMNタンパク質の発現量が足りません。そのままでは運動神経が徐々に失われてしまうため、運動神経の生存を維持できず、運動機能が低下していくというわけです。
ゾルゲンスマの作用機序
以下ゾルゲンスマの添付文書から引用です。
静脈内に投与された本品は、患者の運動ニューロン又は筋細胞等に感染し、 ヒトSMNタンパク質を効率的に発現することで、脊髄性筋萎縮症に対する作用を示すと考えられている。5) なお、本品に搭載された遺伝子発現構成体は、標的細胞の染色体に組み込まれることなくエピソームとして核内に存在し、ヒトSMNタンパク質は長期間安定して発現する。
かなり特殊な機序をしていますが、ざっくり全容をお話します。
脊髄性筋萎縮症ではSMNタンパク質がうまく作れていないことが根本に存在するため、いかにSMNタンパク質を補充するかが大切です。
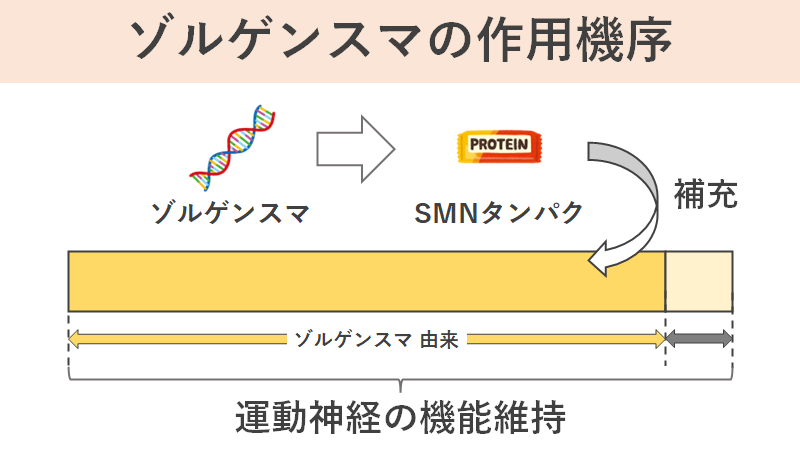
ゾルゲンスマは患者の運動神経内で安定してSMNタンパク質を作り出すことが出来るように設計した特殊なDNAを運動神経細胞まで届けられるようにした薬です。そのDNAによって運動神経内でSMNタンパク質が持続的に作られるため、運動神経の生存が可能になり運動機能が障害されないという理屈です。
また、ゾルゲンスマに含まれる遺伝子自体は患者の染色体に組み込まれるわけではないため、患者の遺伝子自体には影響を与えません。
個人的にすごいなーと思ったところ
以下私が調べてみた感想です。調べていてよくわからないところもあったので、もしご存じの方はコメントで教えてください。
SMNタンパク質の量はどうなのか? 使用するプロモーターによってSMN の発現量は大きく変わると思いますが、ヒトの適正なSMN 発現量に近い値だったりするのでしょうか?運動神経を取ってきてタンパク質量を測定することは不可能な気はしますが…。 タンパク質が足りないからといって、めちゃくちゃ大量に発現させればいいってものでもありません。過剰発現が起こると、それはそれで細胞のタンパク質合成機能に影響を与えたり、細胞機能自体が損なわれたりすると思うのですが、そんなことないのでしょうか? 臨床試験では十分量発現しているとのことですから、発生量が足りないということはなさそうですが、個人的にちょっと気になります。
異物である外部DNAを細胞核内に導入したところ 生体は異物に対して免疫応答を発生します。ゾルゲンスマもその例外ではなく免疫によって排除されるはずですが、運動神経内に移行して症状の改善が出来ています。 つまり、ゾルゲンスマは排除されることなく運動神経に届けることが出来るというわけです。これはどうして可能なのか気になって調べてみました。 どうも、これはAAV9ウイルスベクターのおかげらしいです。AAVベクターは免疫原性が非常に低いため、免疫に排除されることなく細胞内に侵入することが出来るのだとか。ウイルスベクターからはウイルス由来の全DNAが除かれているため、ウイルス由来のDNAがどうこうという話は起きなさそうです。
導入したDNAが染色体に組込まれることなく環状になり、導入遺伝子が持続してタンパク質を発生させているところ 導入するDNAは最初から環状になっているわけではなく、1本鎖DNAの両端を環状になるように設計し、それらが作用することで環状になっているようです。 それだけだと一部2本鎖のわっかになるわけですが、細胞内のDNA修復機構によって1本鎖の部分の相棒が合成されて完全に2本鎖のわっかが出来上がってるらしいです。これはすごい…。
それでは今回は以上です。ここまでお読みいただきありがとうございました。



コメント