今回はリクエストにお答えして、既にこの世にからなくなってしまった薬について解説していきます。
動画版はこちら↓
ガチフロ錠100mg
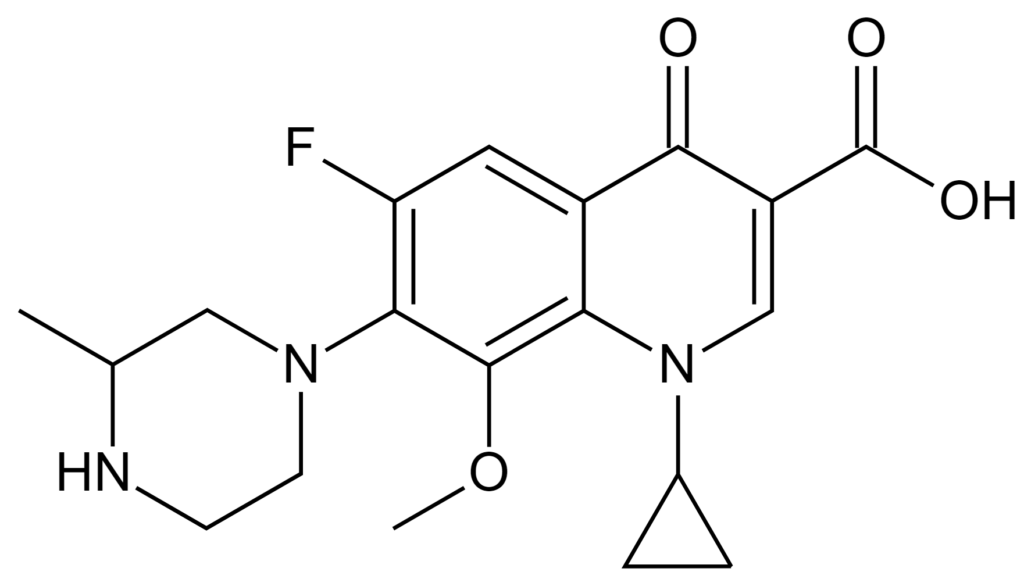
ガチフロ錠は2002年6月に杏林製薬によって販売が開始された、
「ガチフロキサシン」を有効成分としたニューキノロン系の抗菌薬です。
発売当時、ガチフロ錠は多剤耐性菌の出現や副作用の低減など、
当時の感染症治療の課題を解決することを期待されていました。
以下はガチフロ錠が発売された際に出たお知らせです。
2002年6月11日
広範囲経口抗菌薬「ガチフロ®錠100mg」新発売についてのお知らせ杏林製薬株式会社(本社:東京都、社長:荻原郁夫)と大日本製薬株式会社(本社:大阪市、社長:宮武健次郎)は、本日(6月11日)付をもって、広範囲経口抗菌薬「ガチフロ®錠100mg」 (一般名:ガチフロキサシン)を新発売いたしました。
近年、感染症治療においては、多剤耐性菌出現、各種副作用の低減をはじめ、抗菌剤に対する課題が顕在化しております。 杏林製薬(株)はこれらの課題に応えるべく、より優れた有効性と安全性を兼ね備えたニューキノロン剤の開発を目指して研究を進めました。 その結果、日本で初めてキノロン骨格の8位にメトキシ基を導入した Eight Methoxy Quinolone(EMQ)である 「ガチフロ®錠100mg」を創製いたしました。
「ガチフロ錠®100mg」は、従来のニューキノロン系抗菌剤の課題であった肺炎球菌をはじめとするグラム陽性菌に加えて、クラミジア・ニューモニエ、肺炎マイコプラズマやペニシリン耐性肺炎球菌(PRSP)等の多剤耐性菌にも強い抗菌力を示すことから、呼吸器感染症にも高い有用性を持つ新世代のニューキノロン系抗菌剤として、臨床的に評価を得ていきたいと考えております。 さらに安全性の面では、ニューキノロン剤特有の光線過敏症の軽減化が期待されるものです。
感染症領域において共に強みをもつ、杏林製薬(株)と大日本製薬(株)の両社は、同一ブランドによる共同販売を通じて、市場への早期浸透を図り、呼吸器をはじめとする各感染症の治療に貢献できるものと期待をしております。なお、初年度の売上高は両社併せて成人用経口抗菌剤市場のシェア約10%を見込んでおります。 また、ピーク時におきましては、成人用経口抗菌剤市場のシェア20%を獲得し、国内における経口抗菌剤のトップシェアを目指してまいります。
以上
※本件は、杏林製薬株式会社との共同発表です。
https://www.sumitomo-pharma.co.jp/release/dainippon/2002/20020611.htmlより引用
このお知らせでは「既存の同種の抗菌薬に対しての優位性があり、副作用面の低減などがされている」と謳われています。このお知らせから、企業の薬への自信が感じ取れるような気がします。
また、ガチフロキサシンは作用機序的に耐性菌の発現しにくい抗菌薬と考えられていました。
ここでは詳しくは解説しませんが、既存の抗菌薬の作用点は1つであったのに対して、ガチフロキサシンは2つ存在していたことがそれに関係しているとされています。「耐性菌の出現」は抗菌薬を使用する上で避けられないことではありますが、これが出現しにくいということは非常に大きなメリットです。
海外での発売状況
ガチフロキサシンを含む製剤は、1999年12月にアメリカで発売されたのを皮切りに、世界各地で承認を受け販売されていました。そのため、日本で承認を受ける際に欧米での使用実績も把握されており、この時点でのガチフロ錠の有効性と安全性は広く認識されていたようです。
また、海外では患者の一部に血糖値異常が発生するという副作用が確認されていました。それを受けて、日本で販売される際には血糖値に異常が起こる恐れから、糖尿病患者に対しては慎重投与とされていました。
ちなみに、海外での発売名はブリストル・マイヤーズ スクイブ社では「TEQUIN」、Grünenthal社では「BONOQ」、韓獨製薬では「ガチフロ錠」として発売されています。
緊急安全性情報の発布
日本でガチフロ錠が販売されてから数か月後、2003年3月に緊急安全性情報が発されました。緊急安全性情報とは
緊急に安全対策上の措置をとる必要があると判断された場合、厚生労働省からの配布指示に基づき、製造販売業者が作成する情報です。
https://www.pmda.go.jp/safety/info-services/drugs/calling-attention/esc-rsc/0001.htmlより引用
その内容は、「ガチフロ錠との関連が否定できない血糖値異常が複数報告されている」というものでした。ガチフロ錠が採用されてから冬にかけて感染症治療に多く用いられた結果、特に高齢の糖尿病患者について血糖値異常による意識障害が発生する等多くの症例が報告されました。その結果、添付文書に警告が記載され、糖尿病患者については禁忌に変更されました。
この変更により血糖値異常の発生件数は減少しました。
販売中止へ
ガチフロ錠はそれからもしばらく血糖値異常に注意しながら使用されていました。
しかし、2006年2月にはFDA(Food and Drug Administration:アメリカ食品医薬品局)からアメリカでの販売元であるブリストル・マイヤーズ スクイブ社へ注意喚起を行うように指導が入りました。それに加えて、2006年3月に、ガチフロキサシンとその他抗菌薬の血糖値異常に関する臨床研究がNEJM(The New England Journal of Medicine)に投稿されました。
それによると、
「ガチフロキサシンは他のニューキノロン系の抗菌薬に比べて、
高齢者において明らかに低血糖の発現頻度が上昇している」
ことが示されました。
https://www.nejm.org/doi/full/10.1056/nejmoa055191DOI: 10.1056/NEJMoa055191
これらの流れを受けて、ブリストル・マイヤーズ スクイブ社は売り上げ減少による収益確保が困難であると判断を下し、TEQUINの販売を2006年6月に終了しました。
そして2008年9月、FDAは承認医薬品リストからガチフロキサシンを削除しています。これはガチフロキサシンのジェネリック医薬品は承認されないということを示しています。
このような状況を踏まえ、販売について様々な検討がなされた結果、
「代替薬がある」「注意喚起を行ったとしても血糖値異常の発生を完全に回避することは難しい」
などの理由から、大日本製薬と杏林製薬から
ガチフロ錠は2008年9月をもって販売を自主的に中止する
ことが発表されました。
ガチフロキサシンのその後
錠剤は販売が中止されてしまいましたが、ガチフロキサシンを含む製剤は他に点眼薬があります。こちらは非常に優秀な目薬で、これについてはこれまで通り現在も販売されています。
そして、血糖値異常は一度も発生していません。
この理由としては、点眼薬と内服薬では体内に入ってくる薬の量に大きな違いがあるためです。
内服の場合は一度に200mg服用することになるのですが、点眼薬の場合は1滴50μLとすると1回あたり150μgのガチフロキサシンが含まれていることになります。両目で使用したとしても300μgです。使用量を単純に比較すると、両方点眼したとしても内服に比べて、600倍以上の用量となります。当然、体内循環に入る量も大きく異なります。
ガチフロキサシンの血糖値異常は、機序は不明でありますが、ガチフロキサシンが存在しているかどうかではなく、ガチフロキサシンがある程度の量存在していたために発生した副作用と考えられます。目薬では体内に入る量が検出不能な程度にごく少量であるため、点眼薬では血糖値異常の副作用は発現していないと考えられます。
それでは今回は以上です。ここまでお読みいただきありがとうございました。



コメント